本プロジェクトと他のいくつかのプロジェクトとの関係は以下の通りである。
(1) 伝統医学・相補代替医療領域のRCTの世界共通の構造化抄録の日本と韓国における発展
構造化抄録を必要な人に届けるプロジェクトは、1991年の “ACP Journal Club” にはじまる。その後、“Evidence-Based Medicine” でも同様のプロジェクトが進行した。
相補代替医療 (Complementary and Alternative Medicine: CAM) 領域では、FACT (Focus on Alternative and Complementary Therapies) が3ヶ月に1回発行の季刊誌として1996年-2016年に刊行された。そのうち、鍼の日本語訳のプロジェクトが 2001年に開始され、過去分の1996年からの分についても翻訳がなされ、通算 150篇となったところで、日本人コメントも含めて以下が2009年に発行された。
鍼のエビデンス:鍼灸臨床評価論文のアブストラクト増補改訂版. 医道の日本社,2009
日本においても、EKATをモデルとしていくつかのプロジェクトがなされた。そのうち東洋医学関係では、2012年には、2010-2011年度厚生労働科学研究 地域医療基盤開発推進研究事業 東アジア伝統医学の有効性・安全性・経済性のシステマティック・レビュー(代表研究者: 津谷喜一郎)において「日本鍼灸エビデンスレポート 2011」、「あん摩・マッサージ・指圧エビデンスレポート 2011」、「漢方治療の経済評価エビデンスレポート 2011」が作成された。
韓国においては、2009年より日本東洋医学会と交流協定書を取り交わしている大韓韓医学会のEBM特別委員会により、2011.7.15に「漢方治療エビデンスレポート 2010 -345のRCT-」(EKAT 2010) の韓国語翻訳版である『 근거중심의 한방처방:임상 근거를 만들고, 전달하며, 사용하는』が 出版された。
続いて、韓国伝統医学に関するエビデンスレポートが、同委員会によりEKATと同じ手法を用いて作成され、2012年1月20日に『근거중심의 한의치료』として出版された。本レポートでは、論文検索は The Cochrane Library (CENTRAL)、PubMed、Korea Institute of Oriental Medicine (KIOM) のデータベース、韓医学関係の17分科会のwebsiteが用いられ、RCT以外のデザインの試験を含む306件の論文(うち RCTは134件)が収集・選択され、ハングルで構造化抄録が作成された。134件のRCTの構造化抄録については、「平成22-23年度厚生労働科学研究 地域医療基盤開発推進研究事業 東アジア伝統医学の有効性・安全性・経済性のシステマティック・レビュー」(代表研究者: 津谷喜一郎)において英訳がおこなわれ、 “Evidence Reports of Korean Medicine Treatment 2010: 132 Randomized Clinical Trials (EKOM 2010)” としてまとめられている。本エビデンスレポートには、77件の鍼灸関係のRCT、27件の植物薬のRCT、1件の両者併用のRCT、27件のその他の韓国伝統医学のRCTから構成されている。
上記のうち、日本の鍼灸 (日本語、英語)、あマ指(日本語、英語)、韓医学 (英語)、漢方治療の経済評価 (日本語)の構造化抄録は以下よりアクセスできる。
東アジア伝統医学エビデンスレポート(Evidence Reports of Traditional East Asian Medicine : ETEAM)
さらに、2016年にはスポーツ鍼灸マッサージが、2017年にはヨガについても、構造化抄録集であるエビデンスレポートが作成され、厚生労働省唐統合医療に係る情報発信等推進事業である下記からアクセス可能となった。
統合医療エビデンス. In.「統合医療」情報発信サイト(Information site for evidencebased Japanese Integrative Medicine (eJIM)
(2) CONSORT声明
RCTを報告する論文の質向上を目指して、CONSORT声明が1996年に公表され、2001年、2010年に改定されている (http://www.consort-statement.org/)。
2010年版は25の項目からなり、論文作成者は、各項目の情報が何ページにあるかを記したチェックリストを付けて投稿するものである。また例数のフローチャートをつけることも要求される。これは解析対象例数によって結果が異なる場合があるためである。これらによってRCT論文の質管理とともに、RCTそのものの質が高まる。なお、日本東洋医学会の投稿規程も、2008年3月改訂版 (日本東洋医学雑誌 2008; 59: 580-89)に「RCT論文の場合は改訂版CONSORT声明 (2001) に準じる」が加えられた。2010年以降は、CONSORT声明 (2010) の使用が求められている。
CONSORT声明のherbal extensionともいえるものが2つ発行されている。
Gagnier JJ, Boon H, Rochon P, Moher D, Barnes J, et al. Reporting randomized controlled trials of herbal interventions: An elaborated CONSORT statement. Annals of Internal Medicine 2006; 144(5): 364-7.(岡部哲郎, 津谷喜一郎訳. ハーブ介入のランダム化比較試験報告: 詳細なCONSORT声明. In: 中山健夫, 津谷喜一郎 (訳). 臨床研究と疫学研究のための国際ルール集 ライフサイエンス出版, 2008. p.156-63)
前者は単味のハーブを、後者は中国の方剤を対象にしたものである。生薬からなるという特性から「介入」についてどう記述すべきかが詳しく書かれている。後者は中国伝統医学の診断体系や臨床経験年数なども考慮され、2006年版、2007年版に引き続き2017年に「中薬複方」として公開された。11年かけた労作である。
EBM特別委員会第3期 (2009-2012) に漢方CONSORT・タスクフォース (KC-TF) が設立された。そこで、EKAT 2009で構造化抄録を作成した論文に関し、その論文での報告が、CONSORT声明にしたがった記載になっているかどうかに関して調査したところ、報告の質が良いものは少ないことが明らかになった。特に、タイトル/抄録においてRCTであるとの記載がない、試験実施施設と期間の記載がない、漢方製剤のメーカー名や一日投与回数の記載がない、ランダム化の方法と保証の記載がない、エントリー患者数, 割付患者数, 解析患者数が不明確、比較対照群の有害事象が記載されていない、などの不備が多くみられた。今後、漢方のRCTに関しても、CONSORT声明に従った報告が求められる。なお、本件は研究として以下で発表された。
RCTはCONSORT声明に準じて報告することが推奨されているが、既存のCONSORT声明と、その拡張版では、漢方製剤の介入を正しく表現できないことが判明した。以上の問題を解決し、漢方製剤に精通していなくてもRCT論文の方法欄等に必要な情報を記載できるように、KC-TFと日本漢方生薬製剤協会の協力のもと、2011年8月に国立医薬品食品衛生研究所・生薬部、独立行政法人 医薬基盤研究所 薬用植物資源研究センターによりKCONSORTのページが英文で公開された 。本ページは、漢方製剤のRCT論文を書く際、研究に使用した漢方製剤に関する情報を著者が論文中に詳細に記載するのではなく、漢方製剤の詳細情報が収載されている本websiteのアドレスを記載することで代替することを意図したものである。なお、KCONSORTについてはその後、CONSORT声明で示されているチェックリスト25項目のうちIntervention (介入) の1項目しか扱っていないことなどから、2017年5月に正式名称を以下のSTORKと改称として公開している。
CONSOR声明はその後、疫学研究、システマティック・レビューなどの多様な研究デザイン、また上記した広く相補代替医療 (complementary and alternative medicine: CAM) などに展開 (extension) した。こうした状況下で、それら全体の、論文作成に当たってのガイドライン (publication guideline) をカバーしアクセス性を高め、また将来のガイドラインの作成をサポートする “Equator Network” が2008年6月に設立された
このうち主たるものの日本語訳は以下に含まれる。
またその他を含んで下記からもアクセス可能である。
(3) 臨床試験の登録公開
2008年10月修正のヘルシンキ宣言では第19項に「すべての臨床試験は、最初の被験者を募集する前に、一般的にアクセス可能なデータベースに登録されなければならない。」(Every clinical trial must be registered in a publicly accessible database before recruitment of the first subject) が入った。しかしこのことはあまり知られていない。そこでここでは、それまでの歴史的経緯を含めて述べることとする。
臨床試験の登録公開 (clinical trial registry: CTR) は、1990年代に「エビデンスに基づく医療」(evidence-based medicine: EBM) が盛んになり、注目されるようになったものである。特に、1992年にEBMの情報インフラの一翼をなすコクラン共同計画 (The Cochrane Collaboration) が設立され、システマティック・レビュー(SR)が本格的になされるようになり問題がより明らかなった。SRはメタアナリシス (meta analysis: MA) とほぼ同義としてよい。
いかに網羅的な調査を行いstudyを探し、その質を吟味し、高度の統計学的方法を用いて統合しても、実施されたstudyが報告されていなければバイアスが入るという問題がおきる。これは「パブリケーション・バイアス」として知られる。これによって、医療において種々の意思決定を行うもの、すなわち医療従事者、政策決定者、医療消費者などが、間違えた意思決定をなすことになる。無効な治療法、有害な治療法、費用対効果が悪い治療を「つかって」しまうのである。
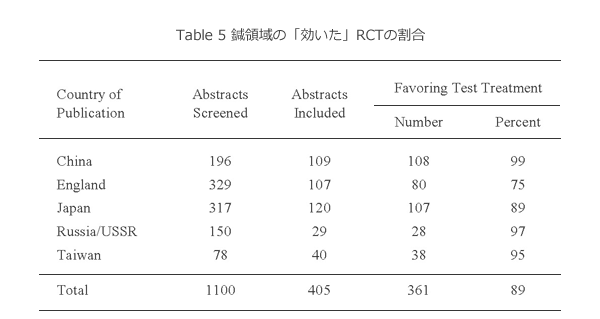
Table 5に、鍼の分野の例を示す。1966-1995 年の期間でMedlineを検索しabstractつきの論文について結果を調査すると、中国では109編の論文のうち108編、99%が “favor to treatment”、つまり鍼がコントロール群に比較して「効いて」いるのである。イングランドは75%であるが、日本を含めてその他の国も同様である。これは「効かなかった」studyが論文化されていないことを示す、と一般には解釈される。
こうした事態は、システマティック・レビューの研究者間では広く知られていた。このバイアスを避けるため、研究者の倫理に訴える、法制化する、websiteを設定しそこに計画中や進行中の臨床試験を登録する、などいくつかの方法が論じられたが、具体的な方法は充分に確立しなかった。
一方、米国国立保健研究所 (NIH) の国立医学図書館 (NLM) は、1997年のUS-FDA近代化法(FDA Modernization Act)にもとづき、生命を脅かす疾患 (life threatening disease) については、患者の臨床試験に対するアクセスを促進する目的で、2003年に “ClinicalTrials.gov” を設立した (https://clinicaltrials.gov)。このシステムはパブリケーション・バイアスを避けるのが主目的ではないが、一部はその機能を持つことになった。ただし、疾患はがん、AIDS、アルツハイマー病などに限られていた。
ところが、2004年6月3日のNew York Timeの1面に掲載された、Glaxo SmithKline社のスキャンダルを契機に世界が動くようになった。小児に対する抗うつ剤の臨床試験で自殺企図の有害事象があったにもかかわらず、それが適正に報告されなかった、というものである。ここで一挙に臨床試験登録を義務づけるべきという論調が世界的に高まった。類似の臨床試験の参加者にとってのリスク、さらには「利他主義」(altruism) にもとづく試験参加者の善意が無視されることなど、生命倫理の問題が顕在化したのである。
2004年9月には医学雑誌編集者国際委員会 (ICMJE) が声明を出し、臨床試験が事前に登録されていなければその原稿を受け付けない、とした(すでに進行中のものは猶予期間が設けられた)。同年10月のコクラン・コロキウムでは「オタワ宣言」がだされた。WHOも動き、翌2005年4月にジュネーブのWHO本部で“WHO Technical Consultation on Clinical Trial Registration Standard Meeting”が開催され、登録すべき20項目などが決められた。
この2004年-2005年の動向は、以下にまとめられている。
(1) 臨床試験の登録と結果の公開 (ポジティブ, ネガティブを含めて. 第25回日本臨床薬理学会年会・シンポジウム12. 2004.9.18, 静岡. 臨床医薬 2005; 21(1): 3-62
(2) 「臨床試験登録に関する「オタワ声明」と「ジュネーブ会議」の動向」. 薬理と治療 2005; 33(6): 543-66
http://www.lifescience.co.jp/yk/jpt_online/ottawa/index_ottawa.html(3) UMIN臨床試験登録システム シンポジウム (2005.2.2)
https://upload.umin.ac.jp/ctr/symposium20050202.htm
日本では、UMIN-CTR(2005.6-)、日本医薬品情報センター (JAPIC) によるJAPIC-CTI(2005.7-)日本医師会治験促進センター (JMACCT) によるもの(2005.12-)の3つのシステムが始まり、2007年4月以降の、厚生労働科学研究費補助金のうち、介入を伴う臨床研究については登録が義務付けられた。また2009年4月以降、厚生労働省による「臨床研究に関する倫理指針」でも義務づけられ、その後、先の臨床研究法(平成29年法律第16号)においても、特定臨床研究について義務付けられている。なお、この法令に基づき臨床研究実施計画・研究概要公開システム (Japan Registry of Clinical Trials;jRCT)が新設された。
それらは国立保健医療科学院のJPRN (2008.10-) を通して、2008年に公式にスタートした、WHOのInternational Clinical Trials Registry Platform (ICTRP) に送られて世界中どこからでもone clickで 検索可能となっている。現在、日本で登録されているものは漢方製剤を含めてここから検索できる。
(4) The Cochrane Library (CENTRAL)
The Cochrane Library (CENTRAL)はRCTの世界的なデータベースのプラットフォームであるが、EKATに収載されている漢方製剤のRCT論文のうち、CENTRALに収載されているものは、EKAT 2010では345件中67件のみであった。代替医療分野のRCTのCENTRALへの収録はメリーランド大学 統合医療センター (Center for Integrative Medicine, University of Maryland Medical School) が担当していることから、連絡を取り、EKATに収録されているRCT論文を CENTRALに収載できないかの交渉を行った。交渉の結果、EKAT 2010の漢方RCT論文を CENTRALに収載し、そこから、日本東洋医学会の EKATの構造化抄録(英語)にリンクをはることとなり、2011年10月の CENTRAL更新時に EKAT論文の追加収録が行われた。ただし、著作権の関係から、もともと CENTRALに収載されていた漢方製剤のRCT論文からはリンクははられていない。いずれにせよ、世界的なRCTデータベースである The Cochrane Library (CENTRAL)から352件の漢方製剤の RCTにアクセスが可能となった。エビデンスに基づいて診療ガイドラインを作成する場合、CENTRALを用いてRCT論文を検索する場合が多いが、今回のことで、漢方製剤のRCTがみつけやすくなり、診療ガイドライン(clinical practice guidelines: CPG) において漢方製剤がもれなく評価されることが期待される。
なお、上記のことは、下記の論文に詳しい。
(5) 診療ガイドライン
伝統薬はすでに国際的な商品となっている。日本の漢方製剤は世界的に見ればこの流れから若干遅れている。中国や韓国などの伝統薬製剤についても質の高い構造化抄録が作成されれば、2005年から2006年にかけてWHO西太平洋地域事務局 (WHO Regional Office for the Western Pacific: WPRO) が作成しようとした伝統医学の診療ガイドライン (Clinical Practice Guideline: CPG) などにおいて議論の混乱を減じることができよう。
元雄良治, 津谷喜一郎.伝統医学のグローバル診療ガイドラインは可能か? 日本東洋医学雑誌 2006; 57 (4) : 465-75.
なお、WHO/WPROの伝統医学 CPG作成プロジェクトは日本などの強い反対により2007年の香港での第5回目の会議で中断された。しかし、その後も、中国では継続して作業が進み、2011年に3巻本として出版された。
中国中医学院編. 中医循証臨床実践指南 - 中医内科. 北京: 中国中医薬出版社, 2011
中国中医学院編. 中医循証臨床実践指南 - 専科専病. 北京: 中国中医薬出版社, 2011
中国中医学院編. 中医循証臨床実践指南 -鍼灸. 北京: 中国中医薬出版社, 2011
上記の経緯と、その内容については下記に詳しい。
柳川俊行, 津谷喜一郎. 中薬の国際化と標準化に関する中国の政策. 第5回 中医診療に関する業界標準と診療ガイドライン. 和漢薬 2013; No.720: 3-10.
